Вода с повышенным содержанием марганца. Методы удаления марганца из воды. Очистка воды от марганца с применением накопительных баков
Повышенная мутность характерна как для артезианской, колодезной, так и для водопроводной воды. Мутность вызывают взвешенные и коллоидные частицы, рассеивающие свет. Это могут быть как органические, так и неорганические вещества или те и другие одновременно. Сами по себе взвешенные частицы в большинстве случаев не представляет серьезной угрозы для здоровья, но для современного оборудования, они могут стать причиной преждевременного выхода из строя. Повышенная мутность водопроводной воды часто связана с механическим отрывом продуктов коррозии трубопроводов и биоплёнок, развивающихся в системе центрального водоснабжения. Причиной повышенной мутности артезианских вод обычно являются глинистые или известковые взвеси, а так же образующиеся при контакте с воздухом нерастворимые окислы железа и других металлов.
Качество воды из колодцев наименее стабильно, поскольку грунтовые воды подвержены влиянию внешних факторов. Высокая мутность из колодцев может быть связана с поступлением в грунтовые воды труднорастворимых природных органических веществ из грунтов с техногенным загрязнением. Высокая мутность негативно влияет на эффективность дезинфекции, в результате чего прикрепленные к поверхности частиц микроорганизмы выживают и продолжают развиваться на пути к потребителю. Поэтому снижение мутности часто позволяет улучшить микробиологическое качество воды.
Железо в воде
Высокое содержание железа в водопроводе связано с различными причинами. В водопровод эти примеси попадают в результате коррозии трубопроводов или использования на станциях водоподготовки железосодержащих коагулянтов, а в артезианские воды - в следствие контакта железосодержащих минералами. Содержание железа в артезианских водах в среднем превышают нормативное значение в 2-10 раз. В некоторых случаях превышение может быть до 30-40 раз. Обычно непосредственно после получения артезианская вода не несёт видимых признаков наличия соединений железа, однако при контакте с кислородом воздуха через 2-3 часа возможно появления желтой окраски, а при более продолжительном отстаивании может наблюдаться образование светло-коричневого осадка. Все это является результатом протекания окислительного процесса, в ходе которого выделяется тепло. Стимулирующих развитие в артезианской воде железистых бактерий.
Марганец в воде
Примеси марганца из артезианских скважин обнаруживается одновременно с примесями железа. Источник их поступления один и тот же - растворение марганцесодержащих минералов. Превышение содержания марганца в питьевой воде ухудшает её вкус, а при использовании для хозяйственно-бытовых нужд наблюдается образование тёмных отложений в трубопроводах и на поверхностях нагревательных элементов. Мытье рук с высоким содержанием марганца приводит к неожиданному эффекту - кожа сначала сереет, а потом и вовсе чернеет. При продолжительном уподоблении воды с высоким содержанием марганца повышается риск развития заболеваний нервной системы.
Окисляемость и цветность
Повышенная окисляемость и цветность поверхностных и артезианских источников водоснабжения свидетельствует о наличии примесей природных органических веществ - гуминновых и фульвокислот, являющихся продуктами разложения объектов живой и неживой природы. Высокое содержание органических веществ в поверхностных водах фиксируются в период гниения водорослей (июль - август). Одной из характеристик концентрации органических загрязнений является перманганатная окисляемость. В области залегания торфа, особенно в районах крайнего севера и восточной Сибири, этот параметр может в десятки раз превышать допустимые значение. Сами по себе природные органические вещества не представляют угрозы для здоровья. Однако при одновременном присутствии железа и марганца образуются их органические комплексы, затрудняющие их фильтрацию методом аэрации, то есть окисление кислородом воздуха. Наличие органических веществ природного происхождения затрудняет дезинфекцию воды окислительными методами, так как образуются побочные продукты дезинфекции. К их числу тригалометанны, галогенуксуснаякислота, галокетоны и галоацетонитрил. Большинство исследований показывают, что вещества данной группы обладают концерагенным эффектом, а так же оказывают негативное влияние на органы пищеварительной и эндокринной систем. Основным способом предотвращения образования побочных продуктов дезинфекции является ее глубокая очистка от природных органических веществ перед стадией хлорирования, однако традиционные методы централизованной водоподготовки этого не обеспечивают.
Запах воды. Вода с запахом сероводорода
Запах водопроводной, артезианской и колодезной воды делают её непригодной для употребления. При оценке качества воды потребители ориентируются на индивидуальные ощущения запаха, цвета и вкуса.
Питьевая вода не должна каким-либо запахом, заметным для потребителя.
Причиной запаха водопроводной воды чаще всего является растворенный хлор, поступающий в воду на стадии дезинфекции при централизованной водоподготовке.
Запах артезианской может быть связан с наличием растворенных газов - сероводорода, оксида серы, метана, аммиака и другими.
Некоторые газы могут быть продуктами жизнедеятельности микроорганизмов или результатом техногенного загрязнения источников водоснабжения.
Колодезная вода наиболее подвержена посторонним загрязнениям, поэтому часто неприятный запах может быть связан с присутствием нефтепродуктов и следов бытовой химии.
Нитраты
Нитраты в колодезной и артезианской воде могут представлять серьезную угрозу для здоровья потребителей, поскольку их содержание может в несколько раз превышать действующий норматив на питьевую воду.
Основной причиной поступления нитратов в поверхностные и подземные воды является миграции компонентов удобрений в почвах.
Употребление с высоким содержанием нитратов приводит к развитию метгемоглобинемии - состояния, характеризующегося появления в крови повышенного значения метгемоглобина (>1%), нарушающего перенос кислорода от легких к тканям. В результате отравления нитратами дыхательная функция крови резко нарушается и может начаться развитие цианоза - синюшней окраски кожи и слизистых оболочек.
Кроме того, рядом исследований показано негативное влияние нитратов на усвоение йода в организме и концерогенный эффект продуктов их взаимодействия с различными веществами человеческого организма.
Жесткость воды. Жесткая и мягкая вода
В основном определяется концентрацией в ней ионов кальция и магния.
Существует мнение, что жесткая вода не несет опасности для здоровья потребителей, но это противоречит выводам многолетних исследований одного из крупнейших специалистов по проблемам питания американскому исследователю Полю Брегу. Он считает, что ему удалось установить причину раннего старения человеческого организма. Причиной этого является жесткая вода. По мнению Поля Брега, соли жесткости «зашлаковывают» кровеносные сосуды так же, как и трубы, по которым протекает вода с высоким содержанием солей жесткости. Это приводит к снижению эластичности сосудов, делая их хрупкими. Особенно это проявляется в тонких кровеносных сосудах коры головного мозга, что по мнению Брега, приводит к старческому маразматизму пожилых людей.
Жесткая вода создает целый ряд бытовых проблем, вызывая образование осадков и налетов на поверхности трубопроводов и рабочих элементах бытовой техники. Эта проблема особенно актуальна для приборов с нагревательными элементами - водогрейных котлов (бойлеров), стиральных и посудомоечных машин.
При использовании жесткой воды в быту слой отложений солей кальция и магния на теплопередающих поверхностях постоянно растет, в результате чего снижается эффективность теплопередачи и увеличивается расход тепловой энергии на нагрев. В отдельных случаях возможен перегрев рабочих элементов и их разрушение.
Очистка воды от фтора
Впервые существование фтора предположил великий химик Лавуазье, еще в XVIII веке, но тогда он не смог выделить его из соединений. После него получить фтор в свободномвиде пытались многие известные ученые, но почти все они либо стали инвалидами из-за этих опытов, либо погибли при их проведении. После этого фтор и назвали «разрушающим» или «несущим гибель». И только в конце XIX века удалось методом электролиза выделить фтор из его соединений.
Как видим, фтор очень опасен, и, тем не менееэлемент с такими свойствами является необходимым для множества живых организмов, в том числе и человека. В артезианской воде фтор содержится в виде соединений.
Фтор - это непростой элемент, и граница между его недостатком и избытком в организме трудноуловима. Дозу фтора очень легко превысить, и тогда он становиться для нашего организма тем, чем и является в природе - ядом.
Фтор содержится в различных продуктах питания: в черном и зеленом чае, морепродуктах, морской рыбе, грецких орехах, в крупах - в овсяной, рисе, гречке, яйцах, печени и т.д. Получить фтор из продуктов питание довольно сложно. Взрослому человеку для получения суточной нормы фтора, необходимо съесть 3,5 кг зернового хлеба, или 700 г лосося, 300 г грецких орехов.
Наиболее легко фтор извлекается из воды. Фтор выполняет в нашем организме много необходимых функций. От него зависит состояние костной системы, её прочность и твердость, состояние и рост волос, ногтей и зубов.
Однако, предупреждаем, что необходимо опасаться превышения фтора в организме. В связи с этим, с нашей точки зрения, не желательно, чтобы концентрация фтора превышала 0,5 - 0,8 мг/л, учитывая, что рекомендуется выпивать в сутки до 2 литров чистой воды. При избытке фтора в организме замедляется обмен веществ и рост, деформируются кости скелета, поражается эмаль зубов, человек слабеет и может появиться рвота, учащается дыхание, падает давление, появляется судорога, поражаются почки.
Марганец в небольших количествах содержится во всех организмах и является микроэлементом. Он регулирует процессы образования крови и функции половых желез, а так же контролирует процесс роста.
Как появляется марганец в воде?
Марганец относится к группе тяжелых металлов . В открытую воду он может поступать вместе с талыми и грунтовыми потоками с тех участков земли, которые «подкармливают» марганцесодержащими удобрениями из-за естественного недостатка этого вещества в почве.
Еще одной возможной причиной называют поднятие воды с глубинных слоев из-за тектонических движений, содержащей некоторое количество марганца, в верхние слои и последующее их смешение. Только при наличии большого количества марганца в воде его можно определить органолептически. Такая вода имеет заметный вяжущий привкус и желтоватую окраску .
Норма примесей марганца в воде
Концентрация марганца в организме человека не превышает тысячных долей процента, поэтому обилие его в воде недопустимо . Доза, обладающая токсичными свойствами для человека равняется 40 мг в день . Летальная доза до сих пор не определена. Лишь в некоторых организмах содержание этого вещества больше. К ним можно отнести свеклу (около 0,3%), муравьев (0,5%) и некоторые бактерии (до нескольких процентов).
Но важно отметить, что во врачебной практике не отмечались случаи отравления из-за высокого содержания марганца в пище или воде, ведь этот элемент относят к наименее ядовитым. Обычно негативное влияние марганца проявляется из-за постоянных выбросов на производстве. При этом же врачи утверждают, что разрушающее влияние этого вещества и конкретно марганцесодержащей воды обычно не проявляется сразу. Для развития клинической картины иногда требуется несколько лет из-за постепенного нарастания количества марганца в организме.
Предельно допустимая концентрация марганца в и воде для бытового использования в России, Украине и других странах СНГ составляет 0,1 миллиграмма на литр воды. В некоторых странах Европы требования ужесточены и принуждают подавать воду населению, где концентрация не превышает 0,05 миллиграмм на литр.
Вред
Избыточное содержание мрганца в воде оказывает негативное воздействие на здоровье человека, бытовую технику и коммуникации.
Вред для здоровья человека и животных
- Накопление марганца в организме приводит к нарушениям в работе центральной нервной системы . Первые признаки этого: быстрая утомляемость, постоянная сонливость, ухудшение памяти. Связано это с резким изменением концентрации микроэлемента и неспособностью организма подстроиться под него.
- Постоянное увеличение количества марганца в организме из-за его поступления с водой может привести к развитию аллергических реакций на совершенно разные вещества.
- Из-за свойств, присущих всем тяжелым металлам, марганец может откладываться в организме. Это выражается в мочекаменной болезни, закупоривании сосудов и, как следствии, сердечно-сосудистых заболеваниях,проблемах с печенью и железами внутренней секреции.
- Из-за возможности закупоривания проходов и одновременного усиления аллергических реакций марганец так же приводит к проблемам с легкими и различным хроническим заболеваниям, например, бронхиту.
- Одну из самых опасных, но пока не рассмотренных проблем представляет собой возможное мутагенное влияние микроэлемента на организм. Конкретных доказательств мутагенным процессам еще нет, но они объясняются перестройкой функций организма, который вынужден подстраиваться под новую концентрацию марганца.
- Избыток приводит к заболеваниям костей . Они становятся более хрупкими и ломкими, резко возрастает опасность переломов.
- При слишком сильном отравлении марганцем может наблюдаться «марганцевое безумие» , проявляющееся в нарушениях поведения, галлюцинациях, агрессивности и т.д. Но количество марганца в воде, способное вызвать такую реакцию, пока не наблюдалось.
Вред для бытовой техники и коммуникационных сетей
Вред для бытовой техники и коммуникационных сетей не слишком силен и примерно одинаков.
- Марганец образует трудно выводимые темно-коричневые или черные пятна на сантехнике , так как осаждается на ее поверхности.
- Отложения накапливаются в трубах и со временем забивают их. Избавиться от марганцовых засоров намного сложнее, чем от простого загрязнения труб. Наросты могут так же образовываться и на бытовой технике.
- В некоторых случаях марганец придает серый или коричневый цвет одежде . Вывести его можно только специальными средствами.
Опасность марганца заключается в его не до конца изученных свойствах и сложностях с его нахождением в воде. Небольшие концентрации этого вещества не вредны для организма, но постоянные накопление могут нанести ущерб. Именно поэтому допустимые нормы содержания жестко контролируются.
Alex , 28 апреля 2016 .Задайте свой вопрос по статье
Чистая питьевая вода – это залог здоровья любого человека. Однако ни колодезная ни водопроводная вода не может гарантировать отсутствия загрязнений.
И если центральные системы водоснабжения оснащены промышленными фильтровальными системами, то вода, добытая на собственном, участке обычно нуждается в качественной очистке. Один из распространенных видов загрязнений – это марганец в воде из скважины.
Норма содержания марганца
Повышенное содержание марганца в воде из скважин, это явление хоть и не слишком частое, но отнюдь и не редкое. Это вещество относится к тяжелым металлам и чаще всего встречается в воде вместе с железом.
Кстати, именно из-за марганца, железо, содержащееся в воде, переходит в трехвалентную нерастворимую форму. Обычно, этот элемент попадает в скважины из верховодки, либо из пластов насыщенных рудой.
Но в любом случае, лучше не допускать превышения максимально допустимых норм содержания. Ведь это чревато серьезными последствиями.
Чем опасно повышенное содержание марганца
Этот элемент оказывает негативное влияние на водопроводную систему, бытовую технику и здоровье человека.
Влияние на водопроводную систему:
- марганец оставляет отложения в водопроводных трубах, чем уменьшает их срок эксплуатации;
- образует накипь на электроприборах;
- от контакта с загрязненной водой остаются пятна.
Влияние на здоровье:
- повышается утомляемость, снижается память, ухудшается общее состояние нервной системы;
- оказывает негативное влияние на состояние скелета;
- способствует развитию аллергических реакций;
- марганец имеет свойство откладываться в организме, поэтому он постепенно зашлаковывается.
Учитывая серьезные последствия, которые влечет за собой высокое содержание этого вещества, вода, в обязательном порядка должна очищаться от марганца. Однако, нужно понимать, что в первую очередь, нужно сдать воду анализ в лабораторию. А уже зная точное содержание, можно планировать меры по очистке.
Очистка от марганца
Фактически, очистка воды от марганца, проводится такими же способами, как и от железа. Т.к. этот элемент относится к металлам и содержится в жидкости в нерастворимой форме, основная задача сводится к его окислению и последующей фильтрации. А это позволяет сделать установку и своими руками.
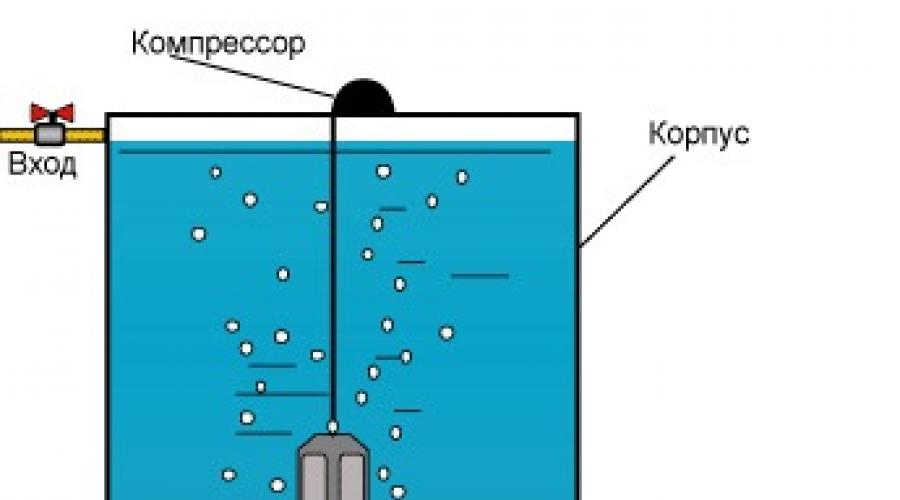
Аэрация
Суть метода сводится к насыщению воды кислородом. Благодаря этому происходит окисление железа и марганца и переход их в растворимую форму. Далее, вода либо отстаивается, либо пропускается через систему картриджных или сорбционных фильтров. Существует два вида аэрации:
- Напорная.
- Безнапорная.
Напорная система стоит дороже и состоит из аэрационной колонны и дополнительных фильтров. В колонну под высоким давлением подается кислород, который активно ее окисляет. Излишки газов выводятся через специальный клапан.
Аэрационная колонна
Достоинства этой системы в ее эффективности и автономии – всеми процессами управляет блок автоматики. Также она не требует установки дополнительного оборудования, поскольку в результате очистки, не теряется давление в системе.
Безнапорная система аэрации, считается более упрощенным вариантом напорной. В этом случае, за основу берется бак большой емкости. Обычно это 700 – 1000 литров. Вода в него поступает через специальные распылители с мелкими форсунками.

Безнапорная аэрация
Сам распылитель устанавливается таким образом, чтобы между ним и поверхностью воды оставалось не менее 1 метра. Благодаря этому, вода успевает хорошо перемешаться с воздухом и окислиться.
Дополнительно устанавливается маломощный компрессор, который осуществляет подачу воздуха в емкость. Поскольку водопровод разрывается за счет использования распылителя, требуется установка насосной станции для закачки воды обратно в систему.
В целом, оба варианта аэрации могут успешно очистить воду от марганца и железа. Дополнительный плюс – это удаление примесей сероводорода.
Отстаивание и механическая очистка
Механическая очистка основана на применении картриджных систем. Это системы грубой очистки, поэтому они подходят лишь для отфильтровывания крупных частиц. Их использование оправданно только в паре с другими видами очистки, т.к. они способны задерживать растворенный марганец и железо.
Например, картриджный фильтр можно установить после аэрационной емкости. А перед ней не лишним будет использование грязевика, который задержит в себе все крупные фракции.
Ионные фильтры
Эти системы основаны на использовании каталитических смол и относятся к реагентным методам. В зависимости от необходимой степени очистки, могут применяться разные виды реагентов.
Принцип действия таких систем основан на замене ионов марганца и железа на натрий. Таким образом, ионные колонны без проблем справляются с растворенными в воде примесями.

Ионизация
В отличие от аэрационных систем, ионные колонны, требует периодической замены реагента. Однако его свойства можно частично восстановить при помощи обычной пищевой соли. Таким образом, его может вполне хватить на 3-4 года использования.
Обратный осмос
Система очистки, основанная на обратном осмосе, считается наиболее эффективной. Она позволяет удалить из воды практически все существующие примеси. В основе этой системы, лежит использование мелкозернистой мембраны.
В результате работы системы, поток воды разделяется на две части – чистая идет в водопровод, а грязная уходит в слив. Однако, обратный осмос имеет и недостатки:
- высокая стоимость системы;
- слишком сильная очистка – немного абсурдно, но это факт. На выходе из установки, получается практически дистиллированная вода. И чтобы использовать ее для питья, потребуется сделать дополнительную минерализацию;
- низкая производительность – из-за технологии очистки, около 2\3 поступающей воды уходит в канализацию.
Чтобы сэкономить, имеет смысл разделять общий водопровод на питьевой и технический. Обратный осмос подключается только к питьевому. Еще один момент – мембрана очень чувствительна к твердым загрязнениям. Поэтому лучше установить перед системой фильтр для грубой очистки.

Система обратного осмоса
Стоимость готовых решений
В зависимости от производительности, а также самого принципа работы, у фильтров для очистки воды от марганца могут быть совершенно разные цены:
Таким образом, можно приобрести фильтр за сравнительно небольшие деньги. При этом нужно помнить, что наилучший результат даст только комплексная очистка воды из скважины. А чтобы правильно подобрать систему, нужно вначале сделать лабораторный анализ воды.
Марганец принято относить к группе тяжелых металлов, это вещество распространено не столь сильно, как железо, но встречается довольно часто, и по своим свойствам напоминает само железо. В результате повышенного содержания марганца в воде на внутренних поверхностях водопроводных труб и водогрейного оборудования начинают накапливаться отложения этого металла, которые, в свою очередь, могут вызывать закупорку и ухудшение процессов теплообмена, поэтому следует задуматься о качественной . Кроме того, такая вода оставляет несмываемые следы на сантехнических устройствах. Стоит также отметить, что это далеко не весь вред, который может принести жидкость с повышенной концентрацией марганца, так марганец в питьевой воде является одной из основных причин ее неприятного вкуса, к тому же употребление такой жидкости для утоления жажды и приготовления пищи негативно сказывается на состоянии человеческого организма. Как показали последние исследования, употребление воды, чрезмерно обогащенной марганцем, приводит к снижению интеллектуальных способностей у детей. Постоянное употребление питьевой воды, в которой концентрация марганца превышает 0,1 мг/л, может спровоцировать возникновение серьезных заболеваний костной системы.
Решения BWT для обезжелезивания воды:
Стоит отметить, что на сегодняшний день проблема повышенного содержания марганца в питьевой и водопроводной воде стоит практически также остро, как и проблема воды с повышенной концентрацией железа. По этой причине во многих современных государствах, в том числе и в Российской Федерации, - это одна из основных задач водоочистки. Не смотря на это, многие люди устанавливают в своих домах и квартирах дополнительные фильтрующие системы с целью получения оптимального состава жидкости, столь необходимой всем живым организмам для нормального существования.
Если в водопроводной или в питьевой воде превышена допустимая концентрация марганца, то жидкость приобретает желтоватый оттенок и имеет малоприятный вяжущий привкус. Пить такую воду не только неприятно из-за плохого вкуса, но и опасно для здоровья. Так, повышенное содержание марганца в питьевой воде грозит заболеваниями печени, в которой, в основном, и концентрируется этот металл. Кроме того, марганец, употребленный вместе с водой, имеет способность проникать в тонкий кишечник, кости, почки, железы внутренней секреции и даже поражать головной мозг. Важно знать, что в результате постоянного употребления питьевой воды, в которой превышено содержание данного химического элемента, может начаться хроническое отравление этим опасным для здоровья металлом. Отравление имеет либо неврологическую, либо легочную форму. В случае неврологической формы отравления у пациента могут наблюдаться следующие симптомы:
- Полное безразличие к происходящим вокруг событиям;
- Сонливость;
- Потеря аппетита;
- Головокружения;
- Сильные головные боли.
Если же отравление было крайне сильным, не исключена потеря координации движений, судороги, боли в спине, резкая перемена настроения. Люди, отравившиеся марганцем, могут внезапно расплакаться или же наоборот расхохотаться. Ко всему вышеперечисленному добавляется повышенный тонус лицевых мышц, который является причиной изменения выражения лица больного. Так что марганец в питьевой воде крайне опасен для здоровья человеческого организма.
Все вышеперечисленное позволяет без тени сомнения заявлять о необходимости очистки питьевой и обычной водопроводной воды в случае, если концентрация марганца превышает допустимые нормы, а точнее 0,1мг/л. Более того в некоторых странах предельная концентрация марганца не превышает 0,05 мг/л - настолько опасным считается это вещество. В целом все существующие на сегодняшний день способы и очищения воды от марганца сводятся к следующему принципу. Первоначально происходит окисление двухвалентного марганца (именно в этой форме он поступает в водопроводные коммуникационные системы из природных источников) до трех- и четырехвалентного марганца. Окисленный четырехвалентный марганец в результате реакции с определенным веществом образует нерастворимый осадок, который устраняется посредством фильтров механической очистки. В роли нерастворимого осадка могут выступать оксиды, гидроксиды или же соли кислот; вид осадка, в первую очередь, зависит от типа используемого реагента и выбранного метода.
Тяжелые металлы — очень опасные токсические вещества. В наши дни, мониторинг уровня разных таких веществ особо важен в промышленных и городских районах.
Хотя все знают, что такое тяжелые металлы , не все знают какие химические элементы всё-таки входят в эту категорию. Есть очень много критерий, по которому, разные учёные определяют тяжелые металлы: токсичность, плотность, атомная масса, биохимические и геохимические циклы, распространение в природе. По одним критериям в число тяжелых металлов входят мышьяк (металлоид) и висмут (хрупкий металл).
Общие факты про тяжелые металлы
Известно более 40 элементов, которые относят к тяжелым металлам. Они имеют атомную массу больше 50 а.е. Как не странно именно эти элементы обладают большой токсичностью даже при малой кумуляции для живых организмов. V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo…Pb, Hg, U, Th…все они входят в эту категорию. Даже при их токсичности, многие из них являются важными микроэлементами , кроме кадмия, ртути, свинца и висмута для которых не нашли биологическую роль.


По другой классификации (а именно Н. Реймерса) тяжелые металлы — это элементы которые имеют плотность больше 8 г/см 3 . Таким образом получится меньше таких элементов: Pb, Zn, Bi, Sn, Cd, Cu, Ni, Co, Sb.
Теоретически, тяжелыми металлами можно назвать всю таблицу элементов Менделеева начиная с ванадия, но исследователи нам доказывают, что это не совсем так. Такая теория вызвана тем, что не все они присутствуют в природе в токсических пределах, да и замешательство в биологических процессах для многих минимальна. Вот почему в эту категорию многие включают только свинец, ртуть, кадмий и мышьяк. Европейская Экономическая Комиссия ООН не согласна с этим мнением и считает что тяжелые металлы это — цинк, мышьяк, селен и сурьма. Тот же Н. Реймерс считает, что удалив редкие и благородные элементы из таблицы Менделеева, остаются тяжелые металлы. Но и это тоже не правило, другие к этому классу добавляют и золото, платину, серебро, вольфрам, железо, марганец. Вот почему я вам говорю, что не всё ещё понятно по этой теме…
Обсуждая про баланс ионов различных веществ в растворе, мы обнаружим, что растворимость таких частиц связанно со многими факторами. Главные факторы солюбилизации являются рН, наличие лигандов в растворе и окислительно-восстановительный потенциал. Они причастны к процессам окисления этих элементов с одной степени окисления к другой, в которой растворимость иона в растворе выше.
В зависимости от природы ионов, в растворе могут происходить различные процессы:
- гидролиз,
- комплексообразование с разными лигандами;
- гидролитическая полимеризация.
Из-за этих процессов, ионы могут переходить в осадок или оставаться стабильными в растворе. От этого зависит и каталитические свойства определённого элемента, и его доступность для живых организмов.
Многие тяжелые металлы образуют с органическими веществами довольно стабильные комплексы. Эти комплексы входят в механизм миграции этих элементов в прудах. Почти все хелатные комплексы тяжелых металлов устойчивы в растворе. Также, комплексы почвенных кислот с солями разных металлов (молибден, медь, уран, алюминий, железо, титан, ванадий) имеют хорошую растворимость в нейтральной, слабощелочной и слабокислой среды. Это факт очень важен, потому что такие комплексы могут продвигаться в растворенном состоянии на большие расстояния. Самые подверженные водные ресурсы — это маломинерализованные и поверхностные водоёмы, где не происходит образование других таких комплексов. Для понимания факторов, которые регулируют уровень химического элемента в реках и озерах, их химическую реакционную способность, биологическую доступность и токсичность, необходимо знать не только валовое содержание, но и долю свободных и связанных форм металла.
В результате миграции тяжелых металлов в металлокомплексы в растворе могут произойти такие последствия:
- В первых, увеличивается кумуляция ионов химического элемента за счёт перехода этих из донных отложений в природные растворы;
- Во вторых, возникает возможность изменения мембранной проницаемости полученных комплексов в отличие от обычных ионов;
- Также, токсичность элемента в комплексной форме может отличаться от обычной ионной формы.
Например, кадмий, ртуть и медь в хелатные формы, имеют меньшую токсичность, чем свободные ионы. Вот почему не правильно говорить о токсичности, биологической доступности, химической реакционной способности только по общему содержанию определённого элемента, при этом, не учитывая долю свободных и связанных форм химического элемента.
Откуда же берутся тяжелые металлы в нашу среду обитания? Причины присутствия таких элементов могут быть сточные воды с разных промышленных объектов занимающийся черной и цветной металлургией, машиностроением, гальванизацией. Некоторые химические элементы входят в состав пестицидов и удобрений и таким образом могут быть источником загрязнения местных прудов.
А если войти в тайны химии, то самым главным виновником повышения уровня растворимых солей тяжелых металлов является кислотные дожди (закисление). Понижение кислотности среды (уменьшение рН) тянет за собою переход тяжелых металлов из малорастворимых соединений (гидроксиды, карбонаты, сульфаты) в более хорошо растворимые (нитраты, гидросульфаты, нитриты, гидрокарбонаты, хлориды) в почвенном растворе.
Ванадий (V)
Надо отметить в первую очередь, что загрязнение этим элементом натуральными способами маловероятна, потому что этот элемент очень рассеян в Земной коре. В природе обнаруживается в асфальтах, битумах, углях, железных рудах. Важным источником загрязнения является нефть.
Содержание ванадия в природных водоёмах
Природные водоёмы содержит ничтожное количество ванадия:
- в реках — 0,2 — 4,5 мкг/л,
- в морях (в среднем) — 2 мкг/л.
В процессах перехода ванадия в растворённом состоянии очень важны анионные комплексы (V 10 O 26) 6- и (V 4 O 12) 4- . Также очень важны растворимые ванадиевые комплексы с органическими веществами, типа гумусовых кислот.
Предельно-допустимая концентрация ванадия для водной среды
Ванадий в повышенных дозах очень вреден для человека. Предельно-допустимая концентрация для водной среды (ПДК) составляет 0,1 мг/л, а в рыбохозяйственных прудах, ПДК рыбхоз ещё ниже — 0,001 мг/л.
Висмут (Bi)
Главным образом, висмут может поступать в реки и озера в результате процессов выщелачивания минералов содержащих висмут. Есть и техногенные источники загрязнения этим элементом. Это могут быть предприятия по производству стекла, парфюмерной продукций и фармацевтические фабрики.
Содержание висмута в природных водоёмах
- Реки и озера содержат меньше микрограмма висмута на литр.
- А вот подземные воды могут содержать даже 20 мкг/л.
- В морях висмут как правило не превышает 0,02 мкг/л.
Предельно-допустимая концентрация висмута для водной среды
ПДК висмута для водной среды — 0,1 мг/л.
Железо (Fe)
Железо — химический элемент не редкий, оно содержится во многих минералах и пород и таким образом в природных водоёмах уровень этого элемента повыше других металлов. Оно может происходить в результате процессов выветривания горных пород, разрушения этих пород и растворением. Образуя разные комплексы с органическими веществами из раствора, железо может быть в коллоидальном, растворённом и в взвешенном состояниях. Нельзя не упомнить про антропогенные источники загрязнения железом. Сточные воды с металлургических, металлообрабатывающих, лакокрасочных и текстильных заводов зашкаливают иногда из-за избытка железа.
Количество железа в реках и озерах зависит от химического состава раствора, рН и частично от температуры. Взвешенные формы соединений железа имеют размер более 0,45 мкг. Основные вещества которые входят в состав этих частиц являются взвеси с сорбированными соединениями железа, гидрата оксида железа и других железосодержащих минералов. Более малые частицы, то есть коллоидальные формы железа, рассматриваются совместно с растворенными соединениями железа. Железо в растворённом состоянии состоит из ионов, гидроксокомплексов и комплексов. В зависимости от валентности замечено что Fe(II) мигрирует в ионной форме, а Fe(III) в отсутствии разных комплексов остаётся в растворённом состоянии.
В балансе соединений железа в водном растворе, очень важно и роль процессов окисления, так химического так и биохимического (железобактерии). Эти бактерии ответственны за переход ионов железа Fe(II) в состояние Fe(III). Соединения трехвалентного железа имеют склонность гидролизовать и выпадать в осадок Fe(OH) 3 . Как Fe(II), так и Fe(III) склоны к образованию гидроксокомплексов типа — , + , 3+ , 4+ , + , в зависимости от кислотности раствора. В нормальных условиях в реках и озерах, Fe(III) находятся в связи с разными растворёнными неорганическими и органическими веществами. При рН больше 8, Fe(III) переходит в Fe(OH) 3 . Коллоидные формы соединений железа самые малоизучены.
Содержание железа в природных водоёмах
В реках и озерах уровень железа колеблется на уровне n*0,1 мг/л, но может повыситься вблизи болот до несколько мг/л. В болотах железо концентрируется в форме солей гуматов (соли гуминовых кислот).
Подземные водохранилища с низким рН содержат рекордные количества железа — до нескольких сотен миллиграммов на литр.
Железо — важный микроэлемент и от него зависят разные важные биологические процессы. Оно влияет на интенсивность развития фитопланктона и от него зависит качество микрофлоры в водоёмах.
Уровень железа в реках и озерах имеет сезонный характер. Самые высокие концентрации в водоёмах наблюдаются зимою и летом из-за стагнации вод, а вот весною и осенью заметно снижается уровень этого элемента по причине перемешивания водных масс.
Таким образом, большое количество кислорода ведёт к окислению железа с двухвалентной формы в трехвалентной, формируясь гидроксид железа, который падает в осадок.
Предельно-допустимая концентрация железа для водной среды
Вода с большим количеством железа (больше 1-2 мг/л) характеризуется плохими вкусовыми качествами. Она имеет неприятный вяжущий вкус и непригодна для промышленных целей.
ПДК железа для водной среды — 0,3 мг/л, а в рыбохозяйственных прудах ПДК рыбхоз — 0,1 мг/л.
Кадмий (Cd)
Загрязнение кадмием может возникнуть во время выщелачивания почв, при разложения разных микроорганизмов которые его накапливают, а также из-за миграции из медных и полиметаллических руд.
Человек тоже виноват в загрязнении этим металлом. Сточные воды с разных предприятий занимающеюся рудообогащением, гальваническим, химическим, металлургическим производством могут содержать большие количества соединений кадмия.
Естественные процессы по снижению уровня соединений кадмия являются сорбция, его потребление микроорганизмами и выпадение в осадок малорастворимого карбоната кадмия.
В растворе, кадмий находится, как правило, в форме органо-минеральных и минеральных комплексов. Сорбированные вещества на базе кадмия — важнейшие взвешенные формы этого элемента. Очень важна миграция кадмия в живых организмов (гидробиониты).
Содержание кадмия в природных водоёмах
Уровень кадмия в чистых реках и озерах колеблется на уровне меньше микрограмма на литр, в загрязнённых водах уровень этого элемента доходит до нескольких микрограммов на литр.
Некоторые исследователи считают, что кадмий, в малых количествах, может быть важным для нормального развития животных и человека. Повышенные концентрации кадмия очень опасных для живых организмов.
Предельно-допустимая концентрация кадмия для водной среды
ПДК для водной среды не превышает 1 мкг/л, а в рыбохозяйственных прудах ПДК рыбхоз — меньше 0,5 мкг/л.
Кобальт (Co)
Реки и озера могут загрязниться кобальтом как следствие выщелачивания медных и других руд, из почв во время разложения вымерших организмов (животные и растения), ну и конечно же в результате активности химических, металлургических и металлообрабатывающих предприятии.
Главные формы соединений кобальта находится в растворенном и взвешенном состояниях. Вариации между этими двумя состояниями могут происходить, из-за изменений рН, температуры и состава раствора. В растворённом состоянии, кобальт содержится в виде органических комплексов. Реки и озера имеют характерность, что кобальт представлен двухвалентным катионом. При наличии большого количества окислителей в растворе, кобальт может окисляться до трехвалентного катиона.
Он входит в состав растений и животным, потому что играет важную роль в их развитии. Входит в число основных микроэлементов. Если в почве наблюдается дефицит кобальта, то его уровень в растениях будет меньше обычного и как следствие могут появиться проблемы со здоровьем у животных (возникает риск возникновения малокровия). Этот факт наблюдается особенно в таежно-лесной нечерноземной зоне. Он входит в состав витамина В 12 , регулирует усвоение азотистых веществ, повышает уровень хлорофилла и аскорбиновой кислоты. Без него растения не могут наращивать необходимое количество белка. Как и все тяжелые металлы, он может быть токсичным в больших количествах.
Содержание кобальта в природных водоёмах
- Уровень кобальта в реках варьирует от несколько микрограммов до миллиграммов на литр.
- В морях в среднем уровень кадмия — 0,5 мкг/л.
Предельно-допустимая концентрация кобальта для водной среды
ПДК кобальта для водной среды — 0,1 мг/л, а в рыбохозяйственных прудах ПДК рыбхоз — 0,01 мг/л.
Марганец (Mn)
Марганец поступает в реки и озера по таким же механизмам, как и железо. Главным образом, освобождение этого элемента в растворе происходит при выщелачивании минералов и руд, которые содержат марганец (черная охра, браунит, пиролюзит, псиломелан). Также марганец может поступать вследствие разложения разных организмов. Промышленность имеет, думаю, самую большую роль в загрязнении марганцем (сточные воды с шахт, химическая промышленность, металлургия).
Снижение количества усваиваемого металла в растворе происходит, как и в случае с другими металлами при аэробных условиях. Mn(II) окисляется до Mn(IV), вследствие чего выпадает в осадок в форме MnO 2 . Важными факторами при таких процессах считаются температура, количество растворённого кислорода в растворе и рН. Снижение растворённого марганца в растворе может возникнуть при его употреблении водорослями.
Мигрирует марганец в основном в форме взвеси, которые, как правило, говорят о составе окружающих пород. В них он содержится как смесь с другими металлами в виде гидроксидов. Преобладание марганца в коллоидальной и растворенной форме говорят о том что он связан с органическими соединениями образуя комплексы. Стабильные комплексы замечаются с сульфатами и бикарбонатами. С хлором, марганец образует комплексы реже. В отличие от других металлов, он слабее удерживается в комплексах. Трехвалентный марганец образует подобные соединения только при присутствии агрессивных лигандов. Другие ионные формы (Mn 4+ , Mn 7+)менее редки или вовсе не встречаются в обычных условиях в реках и озерах.
Содержание марганца в природных водоёмах
Самыми бедными в марганце считаются моря — 2 мкг/л, в реках содержание его больше — до 160 мкг/л, а вот подземные водохранилища и в этот раз являются рекордсменами — от 100 мкг до несколько мг/л.
Для марганца характерны сезонные колебания концентрации, как и у железа.
Выявлено множество факторов, которые влияют на уровень свободного марганца в растворе: связь рек и озер с подземными водохранилищами, наличие фотосинтезирующих организмов, аэробные условия, разложение биомассы (мертвые организмы и растения).
Немаловажная биохимическая роль этого элемента ведь он входит в группу микроэлементов. Многие процессы при дефиците марганца угнетаются. Он повышает интенсивность фотосинтеза, участвует в метаболизме азота, защищает клетки от негативного воздействия Fe(II) при этом окисляя его в трехвалентную форму.
Предельно-допустимая концентрация марганца для водной среды
ПДК марганца для водоёмов — 0,1 мг/л.
Медь (Cu)
Такой важной роли для живых организмов не имеет ни один микроэлемент! Медь — один из самых востребованных микроэлементов. Он входит в состав многих ферментов. Без него почти ничего не работает в живом организме: нарушается синтез протеинов, витаминов и жиров . Без него растения не могут размножаться. Всё-таки избыточное количество меди вызывает большие интоксикации во всех типов живых организмов.
Уровень меди в природных водоёмах
Хотя медь имеет две ионные формы, чаще всего в растворе встречается Cu(II). Обычно, соединения Cu(I) трудно растворимые в растворе (Cu 2 S, CuCl, Cu 2 O). Могут возникнуть разные акваионны меди при наличии всяких лигандов.
При сегодняшнем высоком употреблении меди в промышленности и сельское хозяйство, этот металл может послужить причиной загрязнения окружающей среды. Химические, металлургические заводы, шахты могут быть источниками сточных вод с большим содержанием меди. Процессы эрозии трубопроводов тоже имеют свои вклад в загрязнении медью. Самыми важными минералами с большим содержанием меди считаются малахит, борнит, халькопирит, халькозин, азурит, бронтантин.
Предельно-допустимая концентрация меди для водной среды
ПДК меди для водной среды считается 0,1 мг/л, в рыбохозяйственных прудах ПДК рыбхоз меди уменьшается до 0,001 мг/л.
Молибден (Mo)
Во время выщелачивания минералов с высоким содержанием молибдена, освобождаются разные соединения молибдена. Высокий уровень молибдена может замечаться в реках и озерах, которые находятся рядом с фабриками по обогащению и предприятиями занимающиеся цветной металлургией. Из-за разных процессов осаждения труднорастворимых соединений, адсорбции на поверхности разных пород, а также употребления водными водорослями и растениями, его количество может заметно уменьшится.
В основном в растворе, молибден может находиться в форме аниона MoO 4 2- . Есть вероятность присутствия молибденоорганических комплексов. Из-за того что при окисления молибденита формируются рыхлые мелкодисперсные соединения, повышается уровень коллоидального молибдена.
Содержание молибдена в природных водоёмах
Уровень молибдена в реках колеблется между 2,1 и 10,6 мкг/л. В морях и океанах его содержание — 10 мкг/л.
При малых концентрациях, молибден помогает нормальному развитию организма (так растительного, как и животного), ведь он входит в категорию микроэлементов. Также он является составной частью разных ферментов как ксантиноксилазы. При недостатке молибдена возникает дефицит этот фермента и таким образом могут проявляться отрицательные эффекты. Избыток этого элемента тоже не приветствуется, потому что нарушается нормальный обмен веществ.
Предельно-допустимая концентрация молибдена для водной среды
ПДК молибдена в поверхностных водоёмах должен не превышать 0,25 мг/л.
Мышьяк (As)
Загрязнены мышьяком в основном районы, которые находятся близко к минеральным рудников с высоким содержанием этого элемента (вольфрамовые, медно-кобальтовые, полиметаллические руды). Очень малое количество мышьяка может произойти при разложении живых организмов. Благодаря водным организмам, он может усваиваться этими. Интенсивное усваивание мышьяка из раствора замечается в период бурного развития планктона.
Важнейшими загрязнителями мышьяком считаются обогатительная промышленность, предприятия по производству пестицидов , красителей, а также сельское хозяйство.
Озера и реки содержат мышьяк в два состояния: во взвешенном и растворённом. Пропорции между этими формами может меняться в зависимости от рН раствора и химической композиции раствора. В растворённом состоянии, мышьяк может быть трехвалентном или пятивалентном, входя в анионные формы.
Уровень мышьяка в природных водоёмах
В реках, как правило, содержание мышьяка очень низкое (на уровне мкг/л), а в морях — в среднем 3 мкг/л. Некоторые минеральные воды могут содержать большие количества мышьяка (до несколько миллиграммов на литр).
Больше всего мышьяка могут, содержат подземные водохранилища — до несколько десяток миллиграммов на литр.
Его соединения очень токсичны для всех животных и для человека. В больших количествах, нарушаются процессы окисления и транспорт кислорода к клеткам.
Предельно-допустимая концентрация мышьяка для водной среды
ПДК мышьяка для водной среды — 50 мкг/л, а в рыбохозяйственных прудах ПДК рыбхоз — тоже 50 мкг/л.
Никель (Ni)
На содержание никеля в озерах и реках влияют местные породы. Если рядом с водоёмом находятся месторождения никелевых и железно-никелевых руд концентрации могут быть и ещё больше нормального. Никель может поступить в озера и реки при разложении растениях и животных. Сине-зеленые водоросли содержат рекордные количества никеля по сравнению с другими растительными организмами. Важные отходные воды с высоким содержанием никеля освобождаются при производстве синтетического каучука, при процессах никелирования. Также никель в больших количествах освобождается во время сжигания угля, нефти.
Высокий рН может послужить причиной осаждения никеля в форме сульфатов, цианидов, карбонатов или гидроксидов. Живые организмы могут снизить уровень подвижного никеля, употребляя его. Важны и процессы адсорбции на поверхности пород.
Вода может содержать никель в растворённой, коллоидальной и взвешенной формах (баланс между этими состояниями зависит от рН среды, температуры и состава воды). Гидроксид железа, карбонат кальция, глина хорошо сорбируют соединения содержащие никель. Растворённый никель находится в виде комплексов с фульвовой и гуминовой кислот, а также с аминокислотами и цианидами. Самой стабильной ионной формой считается Ni 2+ . Ni 3+ , как правило, формируется при большом рН.
В середине 50ых годов никель был внесён в список микроэлементов, потому что он играет важную роль в разных процессах как катализатор. В низких дозах он имеет положительный эффект на кроветворные процессы. Большие дозы всё-таки очень опасны для здоровья, ведь никель — канцерогенный химический элемент и может спровоцировать разные заболевания дыхательной системы. Свободный Ni 2+ более токсичный, чем в форме комплексов (примерно в 2 раза).
Уровень никеля в природных водоёмах
Предельно-допустимая концентрация никеля для водной среды
ПДК никеля для водной среды — 0,1 мг/л, а вот в рыбохозяйственных прудах ПДК рыбхоз — 0,01 мг/л.
Олово (Sn)
Природными источниками олова являются минералы, которые содержат этот элемент (станнин, касситерит). Антропогенными источниками считаются заводы и фабрики по производству разных органических красок и металлургическая отрасль работающая с добавлением олова.
Олово — малотоксичный металл, вот почему употребляя пищу из металлических консервов мы не рискуем своим здоровьем.
Озера и реки содержат меньше микрограмма олова на литр воды. Подземные водохранилища могут содержать и несколько микрограммов олова на литр.
Предельно-допустимая концентрация олова для водной среды
ПДК олова для водной среды — 2 мг/л.
Ртуть (Hg)
Главным образом, повышенный уровень ртути в воде замечается в районах где есть месторождения ртути. Самые частые минералы — ливингстонит, киноварь, метациннабарит. Сточная вода с предприятий по производству разных лекарств, пестицидов, красителей может содержать важные количества ртути. Другим важным источником загрязнения ртутью считаются тепловые электростанции (которые используют как горючее уголь).
Его уровень в растворе уменьшается главным образом за счёт морских животных и растений, которые накапливают и даже концентрировать ртуть! Иногда содержание ртути в морских обитателей поднимается в несколько раз больше чем в морской среде.
Природная вода содержит ртуть в две формы: взвешенную (в виде сорбированных соединений) и растворённую (комплексные, минеральные соединения ртути). В определённых зонах океанов, ртуть может появляться в виде метилртутных комплексов.
Ртуть и его соединения очень токсичны. При больших концентрациях, имеет отрицательное действие на нервную систему, провоцирует изменения в крови, поражает секрецию пищеварительного тракта и двигательную функцию. Очень опасны продукты переработки ртути бактериями. Они могут синтезировать органические вещества на базе ртути, которые во много раз токсичнее неорганических соединений. При употреблении рыбы, соединения ртути могут попасть в наш организм.
Предельно-допустимая концентрация ртути для водной среды
ПДК ртути в обычной воде — 0,5 мкг/л, а в рыбохозяйственных прудах ПДК рыбхоз — меньше 0,1 мкг/л.
Свинец (Pb)
Реки и озера могут загрязняться свинцом натуральным путём при смывании минералов свинца (галенит, англезит, церуссит), так и антропогенным путём (сжигание угля, применение тетраэтилсвинца в топливе, сбросы фабрик по рудообогащению, сточные воды с шахт и металлургических заводов). Осаждение соединений свинца и адсорбция этих веществ на поверхности разных пород являются важнейшими натуральными методами понижения его уровня в растворе. Из биологических факторов, к уменьшению уровня свинца в растворе ведут гидробионты.
Свинец в реках и озерах находится во взвешенной и растворённой форме (минеральные и органоминеральные комплексы). Также свинец находится в виде нерастворимых веществ: сульфаты, карбонаты, сульфиды.
Содержание свинца в природных водоёмах
Про токсичность этого тяжелого металла мы наслышаны. Он — очень опасный даже при малых количествах и может стать причиной интоксикации. Проникновение свинца в организм осуществляется через дыхательную и пищеварительную систему. Его выделение из организма протекает очень медленно, и он способен накапливаться в почках, костях и печени.
Предельно-допустимая концентрация свинца для водной среды
ПДК свинца для водной среды — 0,03 мг/л, а в рыбохозяйственных прудах ПДК рыбхоз — 0,1 мг/л.
Тетраэтилсвинец
Он служит в качестве антидетонатора в моторном топливе. Таким образом, основными источниками загрязнения этим веществом — транспортные средства.
Это соединение — очень токсичное и может накапливаться в организме.
Предельно-допустимая концентрация тетраэтилсвинца для водной среды
Предельно-допустимый уровень этого вещества приближается к нулю.
Тетраэтилсвинец вообще не допускается в составе вод.
Серебро (Ag)
Серебро главным образом попадает в реки и озера из подземных водохранилищах и как следствие сброса сточных вод с предприятий (фотопредприятия, фабрики по обогащению) и рудников. Другим источником серебра могут быть альгицидные и бактерицидные средства.
В растворе, самые важные соединения являются галоидные соли серебра.
Содержание серебра в природных водоёмах
В чистых реках и озерах, содержание серебра — меньше микрограмма на литр, в морях — 0,3 мкг/л. Подземные водохранилища содержат до несколько десяток микрограммов на литр.
Серебро в ионной форме (при определённых концентрациях) имеет бактериостатический и бактерицидный эффект. Для того чтобы можно было стерилизовать воду при помощи серебра, его концентрация должна быть больше 2*10 -11 моль/л. Биологическая роль серебра в организм ещё недостаточно известна.
Предельно-допустимая концентрация серебра для водной среды
Предельно-допустимая серебра для водной среды — 0,05 мг/л.